リサーチトピック
リサーチトピック
【FIBER】建石寿枝講師、杉本直己所長らが、ヒト免疫不全ウイルスHIV-1の逆転写反応を阻害する手法を開発
2016/08/19
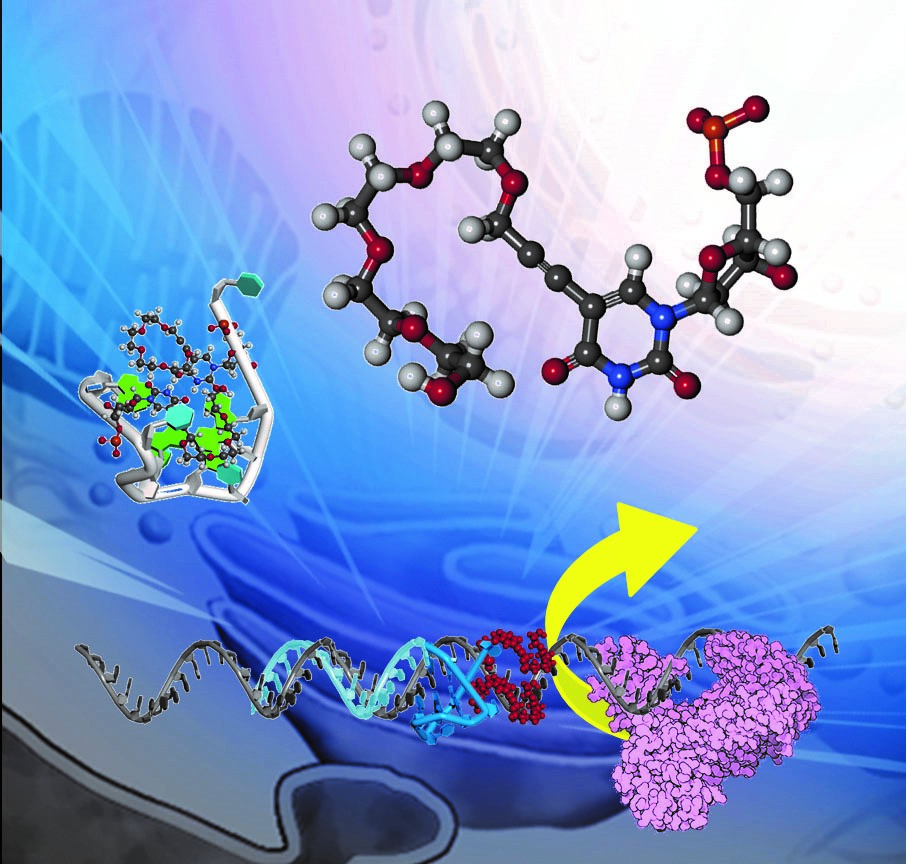
甲南大学先端生命工学研究所の杉本直己所長と建石寿枝講師の研究グループは、ヒト免疫不全ウイルス(HIV)-1の増幅に関わる逆転写反応を高い効率で阻害する技術を開発しました。杉本らは人工核酸をつかって、HIV-1のゲノムRNA上に四重らせん構造(※1)という特殊な構造を安定に形成させる技術を構築しました。四重らせんが形成されると逆転写反応の進行が阻害されるため、HIV-1をはじめとする種々のウイルスの阻害薬の開発に非常に有用です。この研究成果は、2016 年8月4日号の独国学術誌「ChemBioChem誌」に掲載され、表紙に取り上げられました(別紙1)。また、2016年8月17日付けの日刊工業新聞誌の第一面で紹介されました。本研究は東京工業大学金原数教授のグループとの共同研究です。
生体内での核酸(DNA:デオキシリボ核酸、RNA:リボ核酸)の標準的な構造は二重らせん構造ですが、核酸は、四重らせん構造も形成することができます。四重らせん構造が形成されると遺伝情報の伝達に関わる転写反応や、細胞寿命やがん化に関わるテロメアの伸長反応、さらには、感染したウイルスの増幅に関わる逆転写反応などの様々な生体反応が阻害されます。そのため、安定な四重らせんを人工的に形成させる技術は疾患に関わる生体反応を標的とした薬剤の開発に有用です。特に、逆転写反応は、三大感染症の一つであるエイズの原因となるHIV(ヒト免疫不全ウイルス)-1が標的細胞に侵入後、細胞内で増幅するために必須の過程であり、この過程を効率よく阻害する手法の開発が求められています。
これまでの杉本所長らの研究において、このような四重らせん構造の形成・解離は、共存する溶質と四重らせん構造の相互作用によって制御可能であることを示唆する結果が得られていました。そこでこれまでの研究成果を基に、生体適合性が高く、薬剤などの修飾に活用されてきたオリゴエチレングリコールの一種であるテトラエチレングリコール(TEG)をDNAのチミン塩基に共有結合で連結させた人工塩基(TEG修飾塩基)を開発しました(※2)。さらに、このTEG修飾塩基をHIV-1ウイルスのゲノムRNAのグアニンの連続領域と四重鎖を誘起するようなオリゴヌクレオチドを設計しました(※3)。その結果、TEG修飾塩基をもつオリゴヌクレオチドと標的RNAによって形成される四重らせん構造は、天然のオリゴヌクレオチドにより形成される四重らせん構造よりも大きく安定化しました。さらに、HIV-1由来の逆転写酵素を用いた逆転写反応溶液に、TEG修飾塩基をもつオリゴヌクレオチドを添加すると、逆転写反応を70%以上の効率で抑制できることがわかりました。本研究では、逆転写反応を標的としていますが、本研究により開発された安定な四重らせん構造を誘起する技術は、転写、翻訳、テロメア伸長反応の阻害などにも応用できます。そのため、本研究成果は、種々の反応が関わる疾患を標的とした薬剤の開発において非常に有用な知見と考えらえます(特許出願中、特願2015-95059、出願人:学校法人甲南学園)。
先端生命工学研究所(FIBER)は、今後も、生命化学分野における研究開発を通じて、科学技術の振興と研究成果を通じた社会還元に寄与してまいります。
【用語解説】
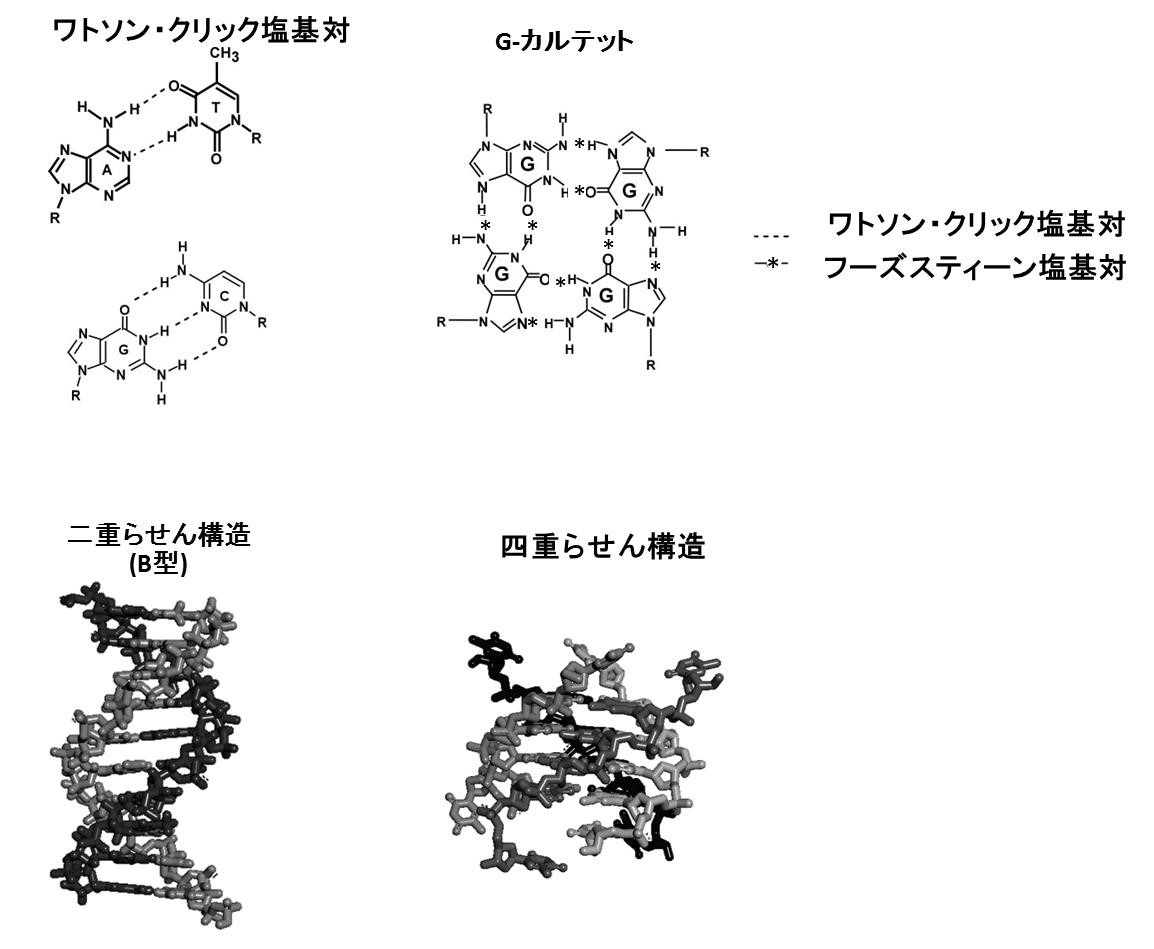
1、核酸の構造と塩基対(※1)
核酸(DNAおよびRNA)にはアデニン(A)、シトシン(C)、グアニン(G)、チミン(T)(RNAではウラシル(U))という4種類の塩基があり、AはT(またはU)と、CはGと結合し(ワトソン・クリック塩基対を形成し)、二重らせん構造をつくる(左下図)。さらに、Gの連続配列から成る核酸はフーグスティーン塩基対によって4つのGが結びついた四重らせん構造もつくることができる(右下図)。
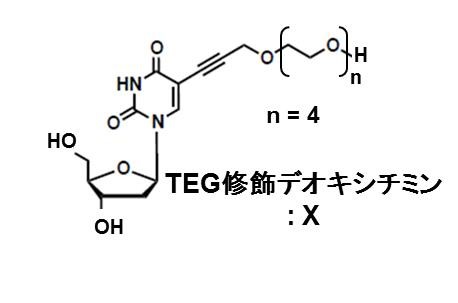
2、TEG修飾チミン(※2)
本件研究により開発されたTEG修飾チミンの化学構造を下記に示します。これまでに細胞内でのヌクレアーゼ耐性を向上させるために核酸の糖部位にオリゴエチレングリコールおよびPEG修飾された核酸は開発されていました。しかし、四重らせん構造の構造解析から、チミンの塩基部位にTEG修飾することで四重らせん構造を安定化できるのではないかという独自の発想の基、塩基部位にTEG修飾が施されたチミン塩基は今回が初めて開発されました。
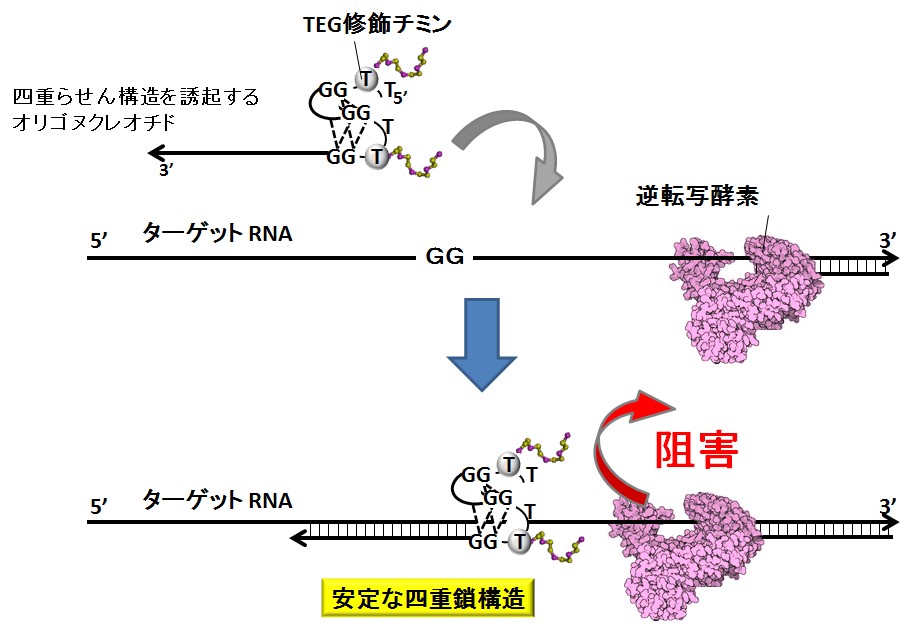
3、四重らせん構造を誘起するオリゴヌクレオチドによる逆転写阻害(※3)
標的RNAと添加したオリゴヌクレオチドによって安定な四重鎖を形成させ、逆転写反応を阻害する概念図。
【別紙1】ChemBioChem 2016年8月4日号の表紙に掲載された図